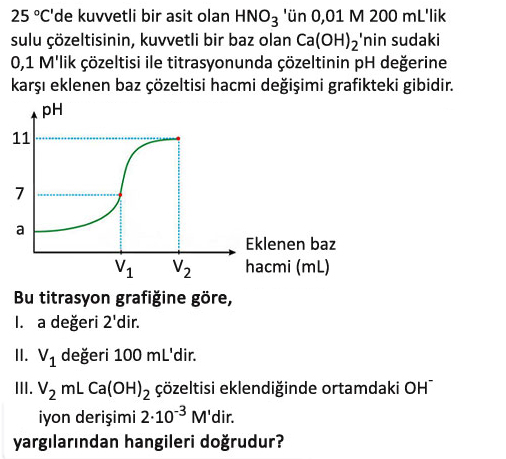
Verilen titrasyon grafiği ve bilgilere göre ifadeleri tek tek değerlendirelim:
I. a değeri 2’dir.
Başlangıçta 0.01 \text{ M } 200 \text{ mL } HNO_3 çözeltisi bulunmaktadır. HNO_3 kuvvetli bir asittir ve suda tamamen iyonlaşır:
HNO_3 (aq) \rightarrow H^+ (aq) + NO_3^- (aq)
Bu nedenle, başlangıçtaki H^+ iyonu derişimi, HNO_3 derişimine eşittir:
[H^+] = 0.01 \text{ M} = 10^{-2} \text{ M}
Çözeltinin başlangıç pH değeri (a) şu şekilde hesaplanır:
pH = -\log[H^+]
pH = -\log(10^{-2})
pH = 2
Dolayısıyla, “a değeri 2’dir.” ifadesi doğrudur.
II. V_1 değeri 100 mL’dir.
V_1, eşdeğerlik noktasındaki eklenen baz hacmidir. Eşdeğerlik noktasında, asitten gelen H^+ iyonlarının mol sayısı, bazdan gelen OH^- iyonlarının mol sayısına eşittir.
Titrasyon denklemi:
2HNO_3 (aq) + Ca(OH)_2 (aq) \rightarrow Ca(NO_3)_2 (aq) + 2H_2O (l)
HNO_3'ün mol sayısı:
Mol HNO_3 = M_{asit} \times V_{asit} = 0.01 \text{ mol/L} \times 0.200 \text{ L} = 0.002 \text{ mol } HNO_3
HNO_3 kuvvetli bir asit olduğu için, H^+ iyonlarının mol sayısı da 0.002 \text{ mol}'dür.
Ca(OH)_2 kuvvetli bir bazdır ve suda şu şekilde iyonlaşır:
Ca(OH)_2 (aq) \rightarrow Ca^{2+} (aq) + 2OH^- (aq)
Her bir mol Ca(OH)_2, 2 mol OH^- iyonu verir.
Eşdeğerlik noktasında (V_1 hacminde Ca(OH)_2 eklendiğinde):
Mol H^+ = \text{Mol } OH^-
0.002 \text{ mol} = 2 \times M_{baz} \times V_{baz}
0.002 \text{ mol} = 2 \times 0.1 \text{ mol/L} \times V_1 (\text{L})
0.002 = 0.2 \times V_1
V_1 = \frac{0.002}{0.2} \text{ L}
V_1 = 0.01 \text{ L}
V_1'i mL cinsinden ifade edersek:
V_1 = 0.01 \text{ L} \times 1000 \text{ mL/L} = 10 \text{ mL}
Dolayısıyla, “V_1 değeri 100 mL’dir.” ifadesi yanlıştır.
III. V_2 \text{ mL } Ca(OH)_2 çözeltisi eklendiğinde ortamdaki OH^- iyon derişimi 2 \cdot 10^{-3} M’dır.
Grafiğe göre, V_2 \text{ mL } Ca(OH)_2 eklendiğinde çözeltinin pH değeri 11’dir.
pH ve pOH arasındaki ilişki:
pH + pOH = 14
11 + pOH = 14
pOH = 14 - 11
pOH = 3
OH^- iyon derişimi şu şekilde hesaplanır:
[OH^-] = 10^{-pOH}
[OH^-] = 10^{-3} \text{ M}
Dolayısıyla, “V_2 \text{ mL } Ca(OH)_2 çözeltisi eklendiğinde ortamdaki OH^- iyon derişimi 2 \cdot 10^{-3} M’dır.” ifadesi yanlıştır.
Sonuç olarak, verilen yargılardan sadece I. ifade doğrudur.
Cevap: Yalnız I