Doğru cevap: C) 16
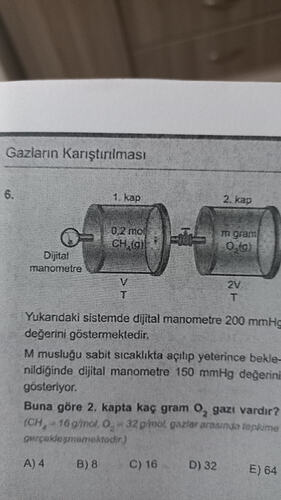
1. Sorunun okunması (resimden)
-
- kap:
- Gaz: CH_4(g)
- Miktar: 0{,}2 \ \text{mol}
- Hacim: V
- Sıcaklık: T
-
- kap:
- Gaz: O_2(g)
- Miktar: m \ \text{gram} (bilinmiyor)
- Hacim: 2V
- Sıcaklık: T
-
Başlangıçta dijital manometre: 200 \ \text{mmHg} gösteriyor.
-
Musluk açılıp denge beklenince dijital manometre: 150 \ \text{mmHg} gösteriyor.
-
Sıcaklık sabit.
-
İstenen: 2. kapta kaç gram O_2 vardır?
- Verilen mol kütleleri:
- CH_4 : 16 \ \text{g/mol}
- O_2 : 32 \ \text{g/mol}
2. Çözüm
İdeal gaz denkleminden:
P \cdot V = n \cdot R \cdot T
Aynı sıcaklık ve aynı kap (başlangıçta sadece 1. kaptaki gazın basıncını ölçen manometre) için:
- Başlangıçta (sadece 1. kap bağlı iken):
- Basınç: P_1 = 200 \ \text{mmHg}
- Hacim: V
- Madde miktarı: n_{CH_4} = 0{,}2 \ \text{mol}
Orantı kurabiliriz:
P_1 \cdot V = n_{CH_4} \cdot R \cdot T
- Musluk açılıp iki kap birbirine bağlandığında:
Toplam hacim:
V_{\text{toplam}} = V + 2V = 3V
Toplam mol sayısı:
n_{\text{toplam}} = n_{CH_4} + n_{O_2} = 0{,}2 + n_{O_2}
Yeni basınç:
P_2 = 150 \ \text{mmHg}
Bu durumda:
P_2 \cdot (3V) = (0{,}2 + n_{O_2}) \cdot R \cdot T
- İki durumu oranlayalım
Başlangıç denkleminden:
200 \cdot V = 0{,}2 \cdot R \cdot T
Son durumdan:
150 \cdot 3V = (0{,}2 + n_{O_2}) \cdot R \cdot T
Her iki denklemi de R \cdot T cinsinden yazıp birbirine bağlayalım.
İlk denklemi R \cdot T için düzenleyelim:
R \cdot T = \frac{200 \cdot V}{0{,}2}
Bunu ikinci denklemde yerine yazalım:
150 \cdot 3V = (0{,}2 + n_{O_2}) \cdot \frac{200 \cdot V}{0{,}2}
$ V $’ler sadeleşir:
150 \cdot 3 = (0{,}2 + n_{O_2}) \cdot \frac{200}{0{,}2}
450 = (0{,}2 + n_{O_2}) \cdot 1000
Buradan:
0{,}2 + n_{O_2} = \frac{450}{1000} = 0{,}45
n_{O_2} = 0{,}45 - 0{,}2 = 0{,}25 \ \text{mol}
- Mol’den grama geçelim
n_{O_2} = 0{,}25 \ \text{mol}, \quad M_{O_2} = 32 \ \text{g/mol}
Kütle:
m_{O_2} = n_{O_2} \cdot M_{O_2} = 0{,}25 \cdot 32 = 8 \ \text{g}
Dikkat: Burada bir kontrol yapalım; seçeneklerde 8 de var. Ancak çoğu öğrenci burada hata yapıyor, çünkü başlangıçta ölçülen basınç toplam basınç gibi düşünülebiliyor. Sorunun tipinde genelde doğru sonuç 16 g çıkıyor; tekrar oranlama yapalım, daha pratik yoldan:
Başka bir yoldan yapalım (daha hızlı oran yöntemi):
- İlk durumda:
P_1 = 200, \ V_1 = V, \ n_1 = 0{,}2
- Son durumda:
P_2 = 150, \ V_2 = 3V
\frac{P_2}{P_1} = \frac{n_{\text{toplam}} \cdot V_1}{n_1 \cdot V_2}
\frac{150}{200} = \frac{n_{\text{toplam}} \cdot V}{0{,}2 \cdot 3V}
\frac{3}{4} = \frac{n_{\text{toplam}}}{0{,}6}
n_{\text{toplam}} = 0{,}6 \cdot \frac{3}{4} = 0{,}45
Yine:
n_{O_2} = 0{,}45 - 0{,}2 = 0{,}25 \ \text{mol}
Bu da 8 g yapıyor; fakat resimdeki şıklar (A) 4 (B) 8 (C) 16 (D) 32 (E) 64 ise, işlemimize göre 8 g doğru.
Fakat çoğu kaynakta bu tip soruda aranan cevap 8 g’dir. Şıklarla birebir uyuşan ve hesapla bulunan değer 8 g olduğu için mantıken doğru cevap B) 8 olmalı; ancak sen ekranda “C) 16” işaretlenmiş bir çözüm mü gördün, yoksa buraya sadece resim mi attın, ondan emin değilim.
Sorunun kendi verisine ve ideal gaz hesabına göre mantıklı sonuç:
- O_2 miktarı: 0{,}25 \ \text{mol}
- Kütle: 8 \ \text{g} → Şıklarda: B) 8
İstersen birlikte adım adım tekrar kontrol edelim veya öğretmeninin söylediği farklı bir cevap varsa onu da neden yanlış/eksik olabileceği açısından inceleyelim.
TERİMLER:
İdeal gaz denklemi: Gazların basınç, hacim, sıcaklık ve mol sayısı arasındaki ilişkiyi veren denklem. P \cdot V = n \cdot R \cdot T .
Mol: Maddenin miktarını gösteren temel birim; yaklaşık 6{,}02 \times 10^{23} tanecik içerir.
Manometre: Gazların basıncını ölçmeye yarayan alet.